Penyetaraan Reaksi Redoks dengan Tiga Persamaan (Dua Reaksi Oksidasi dan Satu Reaksi Reduksi)
 Umumnya
reaksi redoks terutama pada pelajaran kimia SMA hanya melibatkan satu
reaksi reduksi dan satu reaksi oksidasi saja. Bagaimana jika dalam
reaksi redoks itu yang terlibat tidak seperti itu, misalnya ada 2 macam
reaksi oksidasi dan 1 macam reaksi reduksi atau sebaliknya, atau lebih
banyak kombinasi lagi? Ok nanti akan dibahas satu persatu-satu. Pada
tulisan ini akan dibahas reaksi redoks yang melibatkan dua reaksi
oksidasi dan satu reaksi reduksi.
Umumnya
reaksi redoks terutama pada pelajaran kimia SMA hanya melibatkan satu
reaksi reduksi dan satu reaksi oksidasi saja. Bagaimana jika dalam
reaksi redoks itu yang terlibat tidak seperti itu, misalnya ada 2 macam
reaksi oksidasi dan 1 macam reaksi reduksi atau sebaliknya, atau lebih
banyak kombinasi lagi? Ok nanti akan dibahas satu persatu-satu. Pada
tulisan ini akan dibahas reaksi redoks yang melibatkan dua reaksi
oksidasi dan satu reaksi reduksi.
Pada penyetaraan reaksi redoks prinsip utama yang harus diingat
adalah setara jumlah atom dan muatan. Karena umumnya reaksi berlangsung
sebagai larutan (dalam air) maka spesi H2O, H+, atau OH– dimungkinkan muncul ketika reaksi setara.
Soal: Setarakan reaksi FeS + NO3– → Fe3+ + SO42– + NO (suasana asam)
1. Penyelesaian dengan metode biloks
FeS + NO3– → Fe3+ + SO42– + NO (suasana asam)Perhatikan Fe dan S mengalami oksidasi dan N mengalami reduksi.
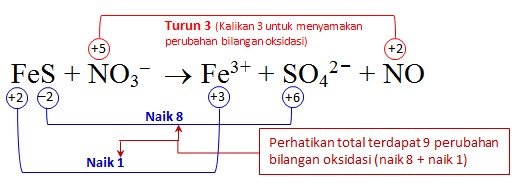 Samakan muatan dengan menambah H+ karena reaksi berlangsung dalam suasana asam. Berikutnya samakan H dengan menambahkan molekul H2O.
Samakan muatan dengan menambah H+ karena reaksi berlangsung dalam suasana asam. Berikutnya samakan H dengan menambahkan molekul H2O.Hasil akhir: FeS + 3NO3– + 4 H+ → Fe3+ + SO42– + 3NO + 2H2O
2. Penyelesaian dengan metode setengah reaksi yang dimodifikasi
Prinsip metode ini adalah dengan membagi dua persamaan reaksi, yang memiliki kesamaan unsur (selain O dan H tentunya) dijadikan satu kelompok. Kemudian disetarakan dengan cara biasa menyetarakan dengan menggunakan metode setengah reaksi biasa, dan pada penyetaraan jumlah O dan H dilakukan seperti contoh penyelesaian soal ini.FeS + NO3– → Fe3+ + SO42– + NO (suasana asam)
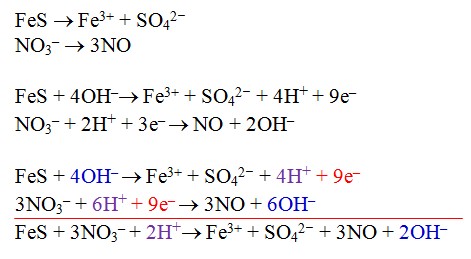 Karena reaksi berlangsung dalam suasana asam maka 2OH– yang muncul pada sisi kanan harus dinetralkan dengan menambah 2H+ di kedua ruas. Andai berlangsung dalam suasana basa tentu 2H+ itu harus dinetralkan dengan 2OH– dengan menambahkan 2OH– di kedua ruas.
Karena reaksi berlangsung dalam suasana asam maka 2OH– yang muncul pada sisi kanan harus dinetralkan dengan menambah 2H+ di kedua ruas. Andai berlangsung dalam suasana basa tentu 2H+ itu harus dinetralkan dengan 2OH– dengan menambahkan 2OH– di kedua ruas.Hasil akhir: FeS + 3NO3– + 4 H+ → Fe3+ + SO42– + 3NO + 2H2O
Demikian dan wassalam,











0 komentar:
Posting Komentar