Cara Alternatif Menyetarakan Reaksi Redoks
 Banyak
jalan menuju Roma. Selalu ada alternatif untuk melakukan sesuatu guna
menghasilkan sesuatu yang sama bahkan mungkin lebih praktis atau simpel.
Demikian pula pada proses menyetarakan reaksi redoks. Cara yang umum
selama ini adalah dengan metode bilangan oksidasi dan metode setengah
reaksi serta metode aljabar yang sangat matematis. Kemudian ada cara
penyetaraan reaksi redoks dengan memodifikasi metode setengah reaksi
itu. Saya juga mendapatinya dengan cara berbeda tepatnya pada perubahan
langkah penyelesaian.
Banyak
jalan menuju Roma. Selalu ada alternatif untuk melakukan sesuatu guna
menghasilkan sesuatu yang sama bahkan mungkin lebih praktis atau simpel.
Demikian pula pada proses menyetarakan reaksi redoks. Cara yang umum
selama ini adalah dengan metode bilangan oksidasi dan metode setengah
reaksi serta metode aljabar yang sangat matematis. Kemudian ada cara
penyetaraan reaksi redoks dengan memodifikasi metode setengah reaksi
itu. Saya juga mendapatinya dengan cara berbeda tepatnya pada perubahan
langkah penyelesaian.
Memang tujuan utama dalam penyetaraan reaksi redoks adalah
menyamakan, atom dan muatan yang terlibat dalam reaksi redoks. Apapun
caranya boleh-boleh saja dalam upaya menyetarakan itu.
Untuk metode yang sudah umum di sini tidak dibahas.
METODE SETENGAH REAKSI YANG DIMODIFIKASI
Metode setengah reaksi yang dimodifikasi seperti bahasan yang ditulis Sukisman Putardi, UNY. Bisa dilihat artikelnya berikut “Modifikasi Metode Setengah Reaksi untuk Menyetarakan Reaksi pada Pembelajaran Konsep Reaksi Redoks dan Elektrokimia di SMA”
kemudian simak bahasannya mulai halaman 105. Cara ini dikatakan
merupakan cara (relatif) mudah untuk menyetarakan reaksi redoks meskipun
masih perlu dilakukan pembuktian di lapangan.
Modifikasi ini ditulis oleh Pak Sukisman Putardi dengan memodifikasi
bagian penyamaan jumlah atom O (oksigen) dengan menambahkan ion OH- dan
menambahkan ion H+ pada ruas yang kekurangan atom H. Hal ini dilakukan
tanpa perlu memperhatikan suasana reaksi berlangsung dalam suasana
apapun (asam, basa, atau netral untuk sementara tidak diperdulikan).
Harapannya siswa tidak dipusingkan terlalu banyak aturan. Kemudian pada
tahap akhir baru dilakukan penyesuaian suasana, jika reaksi redoks
berlangsung dalam suasana asam maka kedua ruas pada tahap akhir ini
ditambahkan ion H+, kalau berlangsung dalam suasana basa kedua ruas
ditambahkan ion OH-.
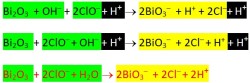
Contoh penerapannya penyetaraan reaksi redoks Bi2O3 + ClO– → BiO3– + Cl– dengan metode setengah reaksi yang dimodifikasi dapat dilihat atau diunduh dari pranala ini.
METODE KOMBINASI (BILOKS DAN SETENGAH REAKSI)
Metode ini adalah metode setengah reaksi tetapi pada proses
penyetaraannya hanya memperhatikan atom yang mengalami perubahan
bilangan oksidasi (biloks) saja.
Tahapan penyataraannya adalah sebagai berikut:
- Menentukan unsur yang mengalami perubahan bilangan oksidasi dan memasangkan sebagai dua persamaan setengah reaksi
- Menyamakan jumlah elektron yang dilepas dan yang diterima dengan mengalikannya dengan bilangan bulat yang sesuai jika diperlukan
- Menyamakan jumlah unsur yang terlibat sesuai persamaan reaksi semula dengan mengalikannya dengan bilangan bulat yang sesuai
- Menjumlahkan semua spesi yang ada pada ruas yang bersesuaian
- Menyesuaikan setiap zat yang terlibat seperti dalam reaksi semula.
- Untuk reaksi berlangsung dalam suasana basa pada ruas yang kelebihan O tambahkan H2O sebanyak lebihnya jumlah O–nya kemudian setarakan jumlah H dengan menambahkan OH- pada ruas lainnya.
- Untuk reaksi berlangsung dalam suasana asam pada ruas yang kekurangan O tambahkan H2O sebanyak kekurangan jumlah O–nya kemudian setarakan jumlah H dengan menambahkan H+ pada ruas yang lainnya.
Setarakan reaksi
- Bi2O3 + ClO– → BiO3– + Cl– (lihat cara penyelesaiaannya atau download dari ini)
- As2S5 + HNO3 → H3AsO4 + H2SO4 + NO2 + H2O (lihat cara penyelesaiaannya atau download dari ini)











0 komentar:
Posting Komentar