Penyetaraan Reaksi Redoks dengan Empat Persamaan (Tiga Reduksi + Satu Oksidasi dan Dua Reduksi + Dua Oksidasi)
 Penyetaraan reaksi redoks berikut ini terinspirasi dari tulisan yang ada di Chemteam.info,
namun di sini digunakan metode yang sedikit berbeda yaitu “Metode
Setengah Reaksi yang Dimodifikasi Tanpa Pengionan”. Diharapkan ini bisa
menyederhanakan teknik yang ada pada penyelesaian yang ditawarkan pada chemteam.info itu. Silakan dibandingkan :)
Penyetaraan reaksi redoks berikut ini terinspirasi dari tulisan yang ada di Chemteam.info,
namun di sini digunakan metode yang sedikit berbeda yaitu “Metode
Setengah Reaksi yang Dimodifikasi Tanpa Pengionan”. Diharapkan ini bisa
menyederhanakan teknik yang ada pada penyelesaian yang ditawarkan pada chemteam.info itu. Silakan dibandingkan :)
Saya sudah coba menyelesaikan dengan metode bilangan oksidasi namun
mendapati kebuntuan, barang kali ada yang bisa membantu menyelesaikan
dengan metode biloks untuk reaksi seperti pada postingan ini, dengan
senang hati, mari berbagi.
SOAL 1 ==Penyetaraan Reaksi Redoks (3 reaksi oksidasi dan 1 reaksi reduksi)==
Problem #1 pada bahasan ChemTeam.info
Metode Setengah Reaksi yang Dimodifikasi Tanpa Pengionan
Soal: K4Fe(CN)6 + Ce(NO3)4 + KOH → Ce(OH)3 + Fe(OH)3 + H2O + K2CO3 + KNO3Jika diperiksa pada reaksi ini terdapat 3 reaksi oksidasi (atom Fe, C, serta N) dan 1 reaksi reduksi (Ce), namun di sini tidak akan digunakan metode bilangan oksidasi untuk menyetarakan reaksi tersebut.
Pasangkan molekul–molekul yang memiliki kesamaan atom (tanpa memperhatikan O dan H)
K4Fe(CN)6 + KOH → Fe(OH)3 + H2O + K2CO3 + KNO3
Ce(NO3)4 + KOH → Ce(OH)3 + KNO3
Setarakan atom selain O dan H
K4Fe(CN)6 + 14KOH → Fe(OH)3 + H2O + 6K2CO3 + 6KNO3
Ce(NO3)4 + 4KOH → Ce(OH)3 + 4KNO3
Setarakan atom O dan H (Tambahkan OH– pada ruas yang kekurangan O, dan tambahkan H+ pada ruas yang kekurangan H), setarakan pula muatannya dengan menambah e–
|x1| K4Fe(CN)6 + 14KOH + 26OH– → Fe(OH)3 + H2O + 6K2CO3 + 6KNO3 + 35H+ + 61e–
|x61| Ce(NO3)4 + + 4KOH + e– → Ce(OH)3 + 4KNO3 + OH–
Jumlah dua buah setengah reaksi
K4Fe(CN)6 + 14KOH + 26OH– → Fe(OH)3 + H2O + 6K2CO3 + 6KNO3 + 35H+ + 61e–
61Ce(NO3)4 + 244KOH + 61e– → 61Ce(OH)3 + 244KNO3 + 61OH–
==============================================================================
K4Fe(CN)6 + 258KOH + 61Ce(NO3)4 → Fe(OH)3 + H2O + 6K2CO3 + 6KNO3 + 35H2O + 61Ce(OH)3 + 244KNO3
Sederhanakan spesi yang muncul dari hasil penjumlah
K4Fe(CN)6 + 258KOH + 61Ce(NO3)4 → Fe(OH)3 + 36H2O + 6K2CO3 + 250KNO3 + 61Ce(OH)3
Metode Penyetaraan Bilangan Oksidasi
Soal: K4Fe(CN)6 + Ce(NO3)4 + KOH → Ce(OH)3 + Fe(OH)3 + H2O + K2CO3 + KNO3Setarakan jumlah atom yang mengalami perubahan bilangan oksidasi dan tentukan banyaknya perubahannya.
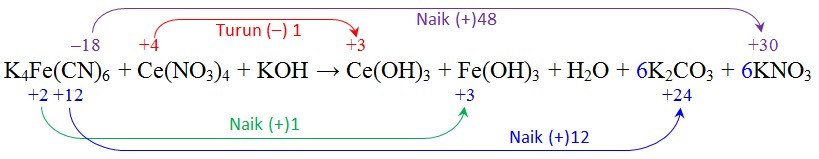 Hitung jumlah perubahan bilangan oksidasi Fe, C, dan N yang terjadi pada molekul K4Fe(CN)6 (48+1+12 = 61) dan setarakan dengan perubahan tersebut dengan yang terjadi pada molekul Ce(NO3)4 (dalam hitungan reaksi tersebut = 1)
Hitung jumlah perubahan bilangan oksidasi Fe, C, dan N yang terjadi pada molekul K4Fe(CN)6 (48+1+12 = 61) dan setarakan dengan perubahan tersebut dengan yang terjadi pada molekul Ce(NO3)4 (dalam hitungan reaksi tersebut = 1)Setelah disetarakan bilangan oksidasi–nya persamaannya menjadi:
K4Fe(CN)6 + KOH + 61Ce(NO3)4 → 61Ce(OH)3 + Fe(OH)3 + H2O + 6K2CO3 + 6KNO3
Setarakan atom atau molekul yang lain dengan metode inspeksi (cek–recek). Di sini dapat dimulai dengan menyetarakan jumlah N, K, dan terakhir jumlah H.
Hasil penyetaraan akhir:
K4Fe(CN)6 + 258KOH + 61Ce(NO3)4 → 61Ce(OH)3 + Fe(OH)3 + 36H2O + 6K2CO3 + 250KNO3
SOAL 2 ==Penyetaraan Reaksi Redoks (3 reaksi oksidasi dan 1 reaksi reduksi)==
Problem #2 pada bahasan ChemTeam.info
Metode Setengah Reaksi yang Dimodifikasi Tanpa Pengionan
Soal: K4Fe(CN)6 + H2SO4 + KMnO4 → MnSO4 + Fe2(SO4)3 + K2SO4 + HNO3 + CO2 + H2OJika diperiksa pada reaksi ini terdapat 3 reaksi oksidasi (atom Fe, C, serta N) dan 1 reaksi reduksi (Mn), namun di sini tidak akan digunakan metode bilangan oksidasi untuk menyetarakan reaksi tersebut.
Pasangkan molekul–molekul yang memiliki kesamaan atom (tanpa memperhatikan O dan H)
K4Fe(CN)6 + H2SO4 → Fe2(SO4)3 + K2SO4 + HNO3 + CO2
H2SO4 + KMnO4 → MnSO4 + K2SO4 + H2O
Setarakan atom selain O dan H
2K4Fe(CN)6 + 7H2SO4 → Fe2(SO4)3 + 4K2SO4 + 12HNO3 + 12CO2
2KMnO4 + 3H2SO4 → 2MnSO4 + K2SO4 + H2O
Setarakan atom O dan H (Tambahkan OH– pada ruas yang kekurangan O, dan tambahkan H+ pada ruas yang kekurangan H), setarakan pula muatannya dengan menambah e–
|x 5| 2K4Fe(CN)6 + 7H2SO4 + 60 OH–→ Fe2(SO4)3 + 4K2SO4 + 12HNO3 + 12CO2 + 62H+ + 122e–
|x 61| 2KMnO4 + 3H2SO4 + 3H+ + 10e– → 2MnSO4 + K2SO4 + H2O + 7OH–
Jumlah dua buah setengah reaksi dan sederhanakan spesi yang muncul pada kedua ruas dari hasil penjumlah
10K4Fe(CN)6 + 35H2SO4 + 300 OH– → 5Fe2(SO4)3 + 20K2SO4 + 60HNO3 + 60CO2 + 310H+ + 610e–
122KMnO4 + 183H2SO4 + 183H+ + 610e– → 122MnSO4 + 61K2SO4 + 61H2O + 427OH–
=============================================================================
10K4Fe(CN)6 + 218H2SO4 + 122KMnO4 → 5Fe2(SO4)3 + 20K2SO4 + 60HNO3 + 60CO2 + 122MnSO4 + 61K2SO4 + 188H2O
SOAL 3 ==Penyetaraan Reaksi Redoks (2 reaksi oksidasi dan 2 reaksi reduksi)==
Problem #5 pada bahasan ChemTeam.info
Metode Setengah Reaksi yang Dimodifikasi Tanpa Pengionan
Soal: CuCNS + KIO3 + HCl → HCN + CuSO4 + ICl + H2O + KClJika diperiksa pada reaksi ini terdapat 2 reaksi oksidasi (atom Cu dan S) dan 2 reaksi reduksi (C dan I), namun di sini tidak akan digunakan metode bilangan oksidasi untuk menyetarakan reaksi tersebut.
Pasangkan molekul–molekul yang memiliki kesamaan atom (tanpa memperhatikan O dan H)
CuCNS → HCN + CuSO4
KIO3 + HCl → ICl + H2O + KCl
Setarakan jumlah atom selain O dan H
CuCNS → HCN + CuSO4
KIO3 + 2HCl → ICl + H2O + KCl
Setarakan jumlah O (tambahkan OH– ruas yang kekurangan O) dan H (tambahkan H+ ruas yang kekurangan H) serta setarakan muatannya dengan menambah e–
|x4| CuCNS + 4OH–→ HCN + CuSO4 + 3H+ + 7e–
|x7| KIO3 + 2HCl + 2H+ + 4e– → ICl + H2O + KCl + 2OH–
Jumlahkan dua reaksi tersebut
4CuCNS + 16OH– → 4HCN + 4CuSO4 + 12H+ + 28e–
7KIO3 + 14HCl + 14H+ + 28e– → 7ICl + 7H2O + 7KCl + 14OH–
=================================================================
4CuCNS + 2OH– + 7KIO3 + 14HCl + 2H+ → 4HCN + 4CuSO4 + 7ICl + 7H2O + 7KCl
Sederhanakan spesi yang muncul pada kedua ruas dari hasil penjumlah
4CuCNS + 2H2O + 7KIO3 + 14HCl → 4HCN + 4CuSO4 + 7ICl + 7H2O + 7KCl
4CuCNS + 7KIO3 + 14HCl → 4HCN + 4CuSO4 + 7ICl + 5H2O + 7KCl
Metode Penyetaraan Bilangan Oksidasi
Soal: CuCNS + KIO3 + HCl → HCN + CuSO4 + ICl + H2O + KClSetarakan atom yang mengalami perubahan bilangan oksidasi saja, kemudian hitung bilangan oksidasinya.
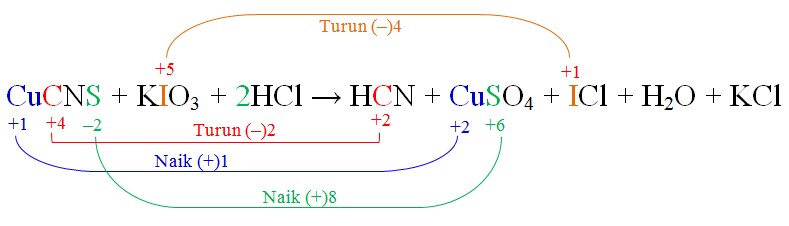 Karena Cu, C, dan S dalam satu molekul CuCNS, maka total perubahan bilangan oksidasi pada CuCNS dapat dijumlahkan menjadi = +1 – 2 + 8 = +7
Karena Cu, C, dan S dalam satu molekul CuCNS, maka total perubahan bilangan oksidasi pada CuCNS dapat dijumlahkan menjadi = +1 – 2 + 8 = +7 Berikutnya adalah menyetarakan bilangan oksidasi antara yang mengalami penaikan (7) dan penurunan (4), sehingga persamaan yang didapat:
(4×1)CuCNS + (7×1)KIO3 + HCl → (4×1)HCN + (4×1)CuSO4 + (7×1)ICl + H2O + KCl
Setarakan atom lain yang tidak mengalami perubahan bilangan oksidasi dengan metode inspeksi (cek dan recek).
4CuCNS + 7KIO3 + 14HCl → 4HCN + 4CuSO4 + 7ICl + 5H2O + 7KCl
Karena reaksi redoks tersebut merupakan bentuk molekuler (tanpa ion), jadi tidak perlu melakukan penyetaraan muatan lagi.
Demikian dan wassalam,











0 komentar:
Posting Komentar