Berusah di Jalan Allah
Kau bisa bersembunyi dari kesalahanmu, tapi tidak dari penyesalan. Kau bisa bermain dengan dramamu, tapi tidak dengan karmamu.
ALLAH
ika Allah yang menjadi tujuan, kenapa harus dikalahkan oleh rintangan-rintangan yang kecil di hadapan Allah? Jika mencari nafkah merupakan ibadah, semakin kerja keras kita, insya Allah semakin besar pahala yang akan diberikan oleh Allah. Jika nafkah yang didapat merupakan bekal untuk beribadah, maka semakin banyak nafkah yang didapat, semakin banyak ibadah yang bisa dilakukan.
Jangan menganggap bahwa kamu sendirian
Hidup itu layaknya waktu yang terus berjalan dan takkan pernah bisa kembali lagi. Jadi pergunakanlah waktumu sebaik mungkin
kegagalan kunci kesuksesan
jika engkau gagal pada hari ini, janganlah engkau berputus asa, karena masih ada hari besok dan seterusnya yang akan mengajakmu menjadi lebih sukses.
Tersenyumlah saat kita terluka :)
Jangan remehkan sesuatu yg sederhana, karena terkadang itu lah yg akan membuatmu bahagia..
Selalu ada Allah yang menemani kita
Ilmu itu lebih baik daripada harta. Ilmu akan menjaga engkau dan engkau menjaga harta. Ilmu itu penghukum (hakim) sedangkan harta terhukum.
Only Allah
“The more we are grateful, the more happiness we get.”
Minggu, 07 Desember 2014
Cara Alternatif Menyetarakan Reaksi Redoks
Cara Alternatif Menyetarakan Reaksi Redoks
 Banyak
jalan menuju Roma. Selalu ada alternatif untuk melakukan sesuatu guna
menghasilkan sesuatu yang sama bahkan mungkin lebih praktis atau simpel.
Demikian pula pada proses menyetarakan reaksi redoks. Cara yang umum
selama ini adalah dengan metode bilangan oksidasi dan metode setengah
reaksi serta metode aljabar yang sangat matematis. Kemudian ada cara
penyetaraan reaksi redoks dengan memodifikasi metode setengah reaksi
itu. Saya juga mendapatinya dengan cara berbeda tepatnya pada perubahan
langkah penyelesaian.
Banyak
jalan menuju Roma. Selalu ada alternatif untuk melakukan sesuatu guna
menghasilkan sesuatu yang sama bahkan mungkin lebih praktis atau simpel.
Demikian pula pada proses menyetarakan reaksi redoks. Cara yang umum
selama ini adalah dengan metode bilangan oksidasi dan metode setengah
reaksi serta metode aljabar yang sangat matematis. Kemudian ada cara
penyetaraan reaksi redoks dengan memodifikasi metode setengah reaksi
itu. Saya juga mendapatinya dengan cara berbeda tepatnya pada perubahan
langkah penyelesaian.Memang tujuan utama dalam penyetaraan reaksi redoks adalah menyamakan, atom dan muatan yang terlibat dalam reaksi redoks. Apapun caranya boleh-boleh saja dalam upaya menyetarakan itu.
Untuk metode yang sudah umum di sini tidak dibahas.
METODE SETENGAH REAKSI YANG DIMODIFIKASI
Metode setengah reaksi yang dimodifikasi seperti bahasan yang ditulis Sukisman Putardi, UNY. Bisa dilihat artikelnya berikut “Modifikasi Metode Setengah Reaksi untuk Menyetarakan Reaksi pada Pembelajaran Konsep Reaksi Redoks dan Elektrokimia di SMA” kemudian simak bahasannya mulai halaman 105. Cara ini dikatakan merupakan cara (relatif) mudah untuk menyetarakan reaksi redoks meskipun masih perlu dilakukan pembuktian di lapangan.
Modifikasi ini ditulis oleh Pak Sukisman Putardi dengan memodifikasi bagian penyamaan jumlah atom O (oksigen) dengan menambahkan ion OH- dan menambahkan ion H+ pada ruas yang kekurangan atom H. Hal ini dilakukan tanpa perlu memperhatikan suasana reaksi berlangsung dalam suasana apapun (asam, basa, atau netral untuk sementara tidak diperdulikan). Harapannya siswa tidak dipusingkan terlalu banyak aturan. Kemudian pada tahap akhir baru dilakukan penyesuaian suasana, jika reaksi redoks berlangsung dalam suasana asam maka kedua ruas pada tahap akhir ini ditambahkan ion H+, kalau berlangsung dalam suasana basa kedua ruas ditambahkan ion OH-.
Contoh penerapannya penyetaraan reaksi redoks Bi2O3 + ClO– → BiO3– + Cl– dengan metode setengah reaksi yang dimodifikasi dapat dilihat atau diunduh dari pranala ini.
METODE KOMBINASI (BILOKS DAN SETENGAH REAKSI)
Metode ini adalah metode setengah reaksi tetapi pada proses penyetaraannya hanya memperhatikan atom yang mengalami perubahan bilangan oksidasi (biloks) saja.
Tahapan penyataraannya adalah sebagai berikut:
- Menentukan unsur yang mengalami perubahan bilangan oksidasi dan memasangkan sebagai dua persamaan setengah reaksi
- Menyamakan jumlah elektron yang dilepas dan yang diterima dengan mengalikannya dengan bilangan bulat yang sesuai jika diperlukan
- Menyamakan jumlah unsur yang terlibat sesuai persamaan reaksi semula dengan mengalikannya dengan bilangan bulat yang sesuai
- Menjumlahkan semua spesi yang ada pada ruas yang bersesuaian
- Menyesuaikan setiap zat yang terlibat seperti dalam reaksi semula.
- Untuk reaksi berlangsung dalam suasana basa pada ruas yang kelebihan O tambahkan H2O sebanyak lebihnya jumlah O–nya kemudian setarakan jumlah H dengan menambahkan OH- pada ruas lainnya.
- Untuk reaksi berlangsung dalam suasana asam pada ruas yang kekurangan O tambahkan H2O sebanyak kekurangan jumlah O–nya kemudian setarakan jumlah H dengan menambahkan H+ pada ruas yang lainnya.
Setarakan reaksi
- Bi2O3 + ClO– → BiO3– + Cl– (lihat cara penyelesaiaannya atau download dari ini)
- As2S5 + HNO3 → H3AsO4 + H2SO4 + NO2 + H2O (lihat cara penyelesaiaannya atau download dari ini)
Membandingkan Metode Setengah Reaksi dengan Metode Setengah Reaksi yang Dimodifikasi
Membandingkan Metode Setengah Reaksi dengan Metode Setengah Reaksi yang Dimodifikasi
 Dalam suasana basa berlangsung reaksi: NO2– + Al → NH3 + AlO2–
Dalam suasana basa berlangsung reaksi: NO2– + Al → NH3 + AlO2–Setarakan reaksi tersebut!
METODE SETENGAH REAKSI BIASA
Soal seperti itu kalau menggunakan cara menyetarakan jumlah O dengan menambahkan H2O sebanyak O yang lebih pada ruas yang kelebihan O tentu akan tidak dapat diselesaikan. Cara lain yang bisa digunakan adalah menyelesaikan seolah reaksi tersebut berlangsung dalam suasana asam, kemudian pada akhir penyetaraan H+ yang muncul dinetralkan dengan menambahkan OH– pada kedua ruas sehingga bagian yang terdapat ion H+ itu ternetralkan dengan terbentuknya molekul H2O. Sebagaimana bahasan pada tulisan ini.
NO2– + 7H+ + 6e– → NH3 + 2H2O (Reaksi reduksi)
Al + 2H2O → AlO2– + 4H+ + 3e– (Reaksi oksidasi)
Menyamakan elektron yang dilepas dan yang diterima:
|x1| NO2– + 7H+ + 6e– → NH3 + 2H2O
|x2|Al + 2H2O → AlO2– + 4H+ + 3e–
Penjumlahan dua setengah reaksi:
NO2– + 7H+ + 6e– → NH3 + 2H2O
2Al + 4H2O → 2AlO2– + 8H+ + 6e–
NO2– + 2Al + 2H2O → NH3 + 2AlO2– + H+
Tahap berikutnya adalah dengan menetralkan ion H+ dengan menambahkan pada kedua ruas dengan ion OH–
NO2– + 2Al + 2H2O + OH– → NH3 + 2AlO2– + H+ + OH–
NO2– + 2Al + 2H2O + OH– → NH3 + 2AlO2– + H2O
NO2– + 2Al + H2O + OH– → NH3 + 2AlO2– …. Setara!
METODE SETENGAH REAKSI YANG DIMODIFIKASI
Cara lain adalah dengan menggunakan metode setengah reaksi yang dimodifikasi (menambahkan OH– pada ruas yang kekurangan O, dan menambahkan H+ pada ruas yang kekurangan H)
NO2– + 5H+ → NH3 + 2OH–
Al + 2OH– → AlO2– + 2H+
Penyetaraan muatan:
NO2– + 5H+ + 6e– → NH3 + 2OH– (Reaksi reduksi)
Al + 2OH– → AlO2– + 2H+ + 3e– (Reaksi oksidasi)
|x1| NO2– + 5H+ + 6e– → NH3 + 2OH–
|x2| Al + 2OH– → AlO2– + 2H+ + 3e–
Penjumlahan dua setengah reaksi:
NO2– + 5H+ + 6e– → NH3 + 2OH–
2Al + 4OH– → 2AlO2– + 4H+ + 6e–
NO2– + 5H+ + 2Al + 4OH– → NH3 + 2OH– + 2AlO2– + 4H+
NO2– + H2O + 2Al + OH– → NH3 + 2AlO2– ….. Setara!
Mana yang lebih mudah? Tentu hasilnya sangat relatif, namun kedua cara di atas memang dapat menyelesaikan persamaan reaksi redoks yang dengan metode biloks atau metode setengah reaksi lainnya (menambahkan H2O pada sisi yang kelebihan O) tidak dapat diselesaikan.
Demikian dan wassalam,
Penyetaraan Reaksi Redoks dengan Tiga Persamaan (Dua Reaksi Oksidasi dan Satu Reaksi Reduksi)
Penyetaraan Reaksi Redoks dengan Tiga Persamaan (Dua Reaksi Oksidasi dan Satu Reaksi Reduksi)
 Umumnya
reaksi redoks terutama pada pelajaran kimia SMA hanya melibatkan satu
reaksi reduksi dan satu reaksi oksidasi saja. Bagaimana jika dalam
reaksi redoks itu yang terlibat tidak seperti itu, misalnya ada 2 macam
reaksi oksidasi dan 1 macam reaksi reduksi atau sebaliknya, atau lebih
banyak kombinasi lagi? Ok nanti akan dibahas satu persatu-satu. Pada
tulisan ini akan dibahas reaksi redoks yang melibatkan dua reaksi
oksidasi dan satu reaksi reduksi.
Umumnya
reaksi redoks terutama pada pelajaran kimia SMA hanya melibatkan satu
reaksi reduksi dan satu reaksi oksidasi saja. Bagaimana jika dalam
reaksi redoks itu yang terlibat tidak seperti itu, misalnya ada 2 macam
reaksi oksidasi dan 1 macam reaksi reduksi atau sebaliknya, atau lebih
banyak kombinasi lagi? Ok nanti akan dibahas satu persatu-satu. Pada
tulisan ini akan dibahas reaksi redoks yang melibatkan dua reaksi
oksidasi dan satu reaksi reduksi.Pada penyetaraan reaksi redoks prinsip utama yang harus diingat adalah setara jumlah atom dan muatan. Karena umumnya reaksi berlangsung sebagai larutan (dalam air) maka spesi H2O, H+, atau OH– dimungkinkan muncul ketika reaksi setara.
Soal: Setarakan reaksi FeS + NO3– → Fe3+ + SO42– + NO (suasana asam)
1. Penyelesaian dengan metode biloks
FeS + NO3– → Fe3+ + SO42– + NO (suasana asam)Perhatikan Fe dan S mengalami oksidasi dan N mengalami reduksi.
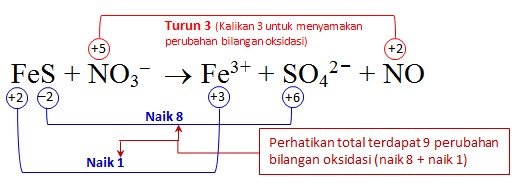 Samakan muatan dengan menambah H+ karena reaksi berlangsung dalam suasana asam. Berikutnya samakan H dengan menambahkan molekul H2O.
Samakan muatan dengan menambah H+ karena reaksi berlangsung dalam suasana asam. Berikutnya samakan H dengan menambahkan molekul H2O.Hasil akhir: FeS + 3NO3– + 4 H+ → Fe3+ + SO42– + 3NO + 2H2O
2. Penyelesaian dengan metode setengah reaksi yang dimodifikasi
Prinsip metode ini adalah dengan membagi dua persamaan reaksi, yang memiliki kesamaan unsur (selain O dan H tentunya) dijadikan satu kelompok. Kemudian disetarakan dengan cara biasa menyetarakan dengan menggunakan metode setengah reaksi biasa, dan pada penyetaraan jumlah O dan H dilakukan seperti contoh penyelesaian soal ini.FeS + NO3– → Fe3+ + SO42– + NO (suasana asam)
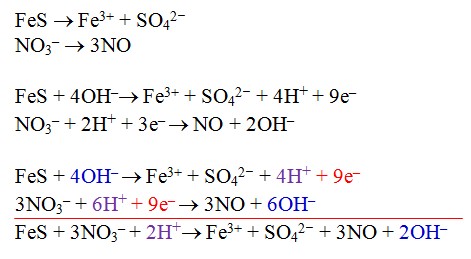 Karena reaksi berlangsung dalam suasana asam maka 2OH– yang muncul pada sisi kanan harus dinetralkan dengan menambah 2H+ di kedua ruas. Andai berlangsung dalam suasana basa tentu 2H+ itu harus dinetralkan dengan 2OH– dengan menambahkan 2OH– di kedua ruas.
Karena reaksi berlangsung dalam suasana asam maka 2OH– yang muncul pada sisi kanan harus dinetralkan dengan menambah 2H+ di kedua ruas. Andai berlangsung dalam suasana basa tentu 2H+ itu harus dinetralkan dengan 2OH– dengan menambahkan 2OH– di kedua ruas.Hasil akhir: FeS + 3NO3– + 4 H+ → Fe3+ + SO42– + 3NO + 2H2O
Demikian dan wassalam,
Penyetaraan Reaksi Redoks dengan Empat Persamaan (Tiga Reduksi + Satu Oksidasi dan Dua Reduksi + Dua Oksidasi)
Penyetaraan Reaksi Redoks dengan Empat Persamaan (Tiga Reduksi + Satu Oksidasi dan Dua Reduksi + Dua Oksidasi)
 Penyetaraan reaksi redoks berikut ini terinspirasi dari tulisan yang ada di Chemteam.info,
namun di sini digunakan metode yang sedikit berbeda yaitu “Metode
Setengah Reaksi yang Dimodifikasi Tanpa Pengionan”. Diharapkan ini bisa
menyederhanakan teknik yang ada pada penyelesaian yang ditawarkan pada chemteam.info itu. Silakan dibandingkan :)
Penyetaraan reaksi redoks berikut ini terinspirasi dari tulisan yang ada di Chemteam.info,
namun di sini digunakan metode yang sedikit berbeda yaitu “Metode
Setengah Reaksi yang Dimodifikasi Tanpa Pengionan”. Diharapkan ini bisa
menyederhanakan teknik yang ada pada penyelesaian yang ditawarkan pada chemteam.info itu. Silakan dibandingkan :)Saya sudah coba menyelesaikan dengan metode bilangan oksidasi namun mendapati kebuntuan, barang kali ada yang bisa membantu menyelesaikan dengan metode biloks untuk reaksi seperti pada postingan ini, dengan senang hati, mari berbagi.
SOAL 1 ==Penyetaraan Reaksi Redoks (3 reaksi oksidasi dan 1 reaksi reduksi)==
Problem #1 pada bahasan ChemTeam.info
Metode Setengah Reaksi yang Dimodifikasi Tanpa Pengionan
Soal: K4Fe(CN)6 + Ce(NO3)4 + KOH → Ce(OH)3 + Fe(OH)3 + H2O + K2CO3 + KNO3Jika diperiksa pada reaksi ini terdapat 3 reaksi oksidasi (atom Fe, C, serta N) dan 1 reaksi reduksi (Ce), namun di sini tidak akan digunakan metode bilangan oksidasi untuk menyetarakan reaksi tersebut.
Pasangkan molekul–molekul yang memiliki kesamaan atom (tanpa memperhatikan O dan H)
K4Fe(CN)6 + KOH → Fe(OH)3 + H2O + K2CO3 + KNO3
Ce(NO3)4 + KOH → Ce(OH)3 + KNO3
Setarakan atom selain O dan H
K4Fe(CN)6 + 14KOH → Fe(OH)3 + H2O + 6K2CO3 + 6KNO3
Ce(NO3)4 + 4KOH → Ce(OH)3 + 4KNO3
Setarakan atom O dan H (Tambahkan OH– pada ruas yang kekurangan O, dan tambahkan H+ pada ruas yang kekurangan H), setarakan pula muatannya dengan menambah e–
|x1| K4Fe(CN)6 + 14KOH + 26OH– → Fe(OH)3 + H2O + 6K2CO3 + 6KNO3 + 35H+ + 61e–
|x61| Ce(NO3)4 + + 4KOH + e– → Ce(OH)3 + 4KNO3 + OH–
Jumlah dua buah setengah reaksi
K4Fe(CN)6 + 14KOH + 26OH– → Fe(OH)3 + H2O + 6K2CO3 + 6KNO3 + 35H+ + 61e–
61Ce(NO3)4 + 244KOH + 61e– → 61Ce(OH)3 + 244KNO3 + 61OH–
==============================================================================
K4Fe(CN)6 + 258KOH + 61Ce(NO3)4 → Fe(OH)3 + H2O + 6K2CO3 + 6KNO3 + 35H2O + 61Ce(OH)3 + 244KNO3
Sederhanakan spesi yang muncul dari hasil penjumlah
K4Fe(CN)6 + 258KOH + 61Ce(NO3)4 → Fe(OH)3 + 36H2O + 6K2CO3 + 250KNO3 + 61Ce(OH)3
Metode Penyetaraan Bilangan Oksidasi
Soal: K4Fe(CN)6 + Ce(NO3)4 + KOH → Ce(OH)3 + Fe(OH)3 + H2O + K2CO3 + KNO3Setarakan jumlah atom yang mengalami perubahan bilangan oksidasi dan tentukan banyaknya perubahannya.
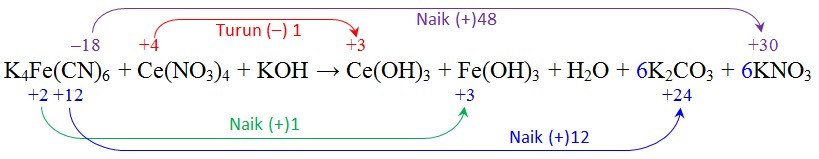 Hitung jumlah perubahan bilangan oksidasi Fe, C, dan N yang terjadi pada molekul K4Fe(CN)6 (48+1+12 = 61) dan setarakan dengan perubahan tersebut dengan yang terjadi pada molekul Ce(NO3)4 (dalam hitungan reaksi tersebut = 1)
Hitung jumlah perubahan bilangan oksidasi Fe, C, dan N yang terjadi pada molekul K4Fe(CN)6 (48+1+12 = 61) dan setarakan dengan perubahan tersebut dengan yang terjadi pada molekul Ce(NO3)4 (dalam hitungan reaksi tersebut = 1)Setelah disetarakan bilangan oksidasi–nya persamaannya menjadi:
K4Fe(CN)6 + KOH + 61Ce(NO3)4 → 61Ce(OH)3 + Fe(OH)3 + H2O + 6K2CO3 + 6KNO3
Setarakan atom atau molekul yang lain dengan metode inspeksi (cek–recek). Di sini dapat dimulai dengan menyetarakan jumlah N, K, dan terakhir jumlah H.
Hasil penyetaraan akhir:
K4Fe(CN)6 + 258KOH + 61Ce(NO3)4 → 61Ce(OH)3 + Fe(OH)3 + 36H2O + 6K2CO3 + 250KNO3
SOAL 2 ==Penyetaraan Reaksi Redoks (3 reaksi oksidasi dan 1 reaksi reduksi)==
Problem #2 pada bahasan ChemTeam.info
Metode Setengah Reaksi yang Dimodifikasi Tanpa Pengionan
Soal: K4Fe(CN)6 + H2SO4 + KMnO4 → MnSO4 + Fe2(SO4)3 + K2SO4 + HNO3 + CO2 + H2OJika diperiksa pada reaksi ini terdapat 3 reaksi oksidasi (atom Fe, C, serta N) dan 1 reaksi reduksi (Mn), namun di sini tidak akan digunakan metode bilangan oksidasi untuk menyetarakan reaksi tersebut.
Pasangkan molekul–molekul yang memiliki kesamaan atom (tanpa memperhatikan O dan H)
K4Fe(CN)6 + H2SO4 → Fe2(SO4)3 + K2SO4 + HNO3 + CO2
H2SO4 + KMnO4 → MnSO4 + K2SO4 + H2O
Setarakan atom selain O dan H
2K4Fe(CN)6 + 7H2SO4 → Fe2(SO4)3 + 4K2SO4 + 12HNO3 + 12CO2
2KMnO4 + 3H2SO4 → 2MnSO4 + K2SO4 + H2O
Setarakan atom O dan H (Tambahkan OH– pada ruas yang kekurangan O, dan tambahkan H+ pada ruas yang kekurangan H), setarakan pula muatannya dengan menambah e–
|x 5| 2K4Fe(CN)6 + 7H2SO4 + 60 OH–→ Fe2(SO4)3 + 4K2SO4 + 12HNO3 + 12CO2 + 62H+ + 122e–
|x 61| 2KMnO4 + 3H2SO4 + 3H+ + 10e– → 2MnSO4 + K2SO4 + H2O + 7OH–
Jumlah dua buah setengah reaksi dan sederhanakan spesi yang muncul pada kedua ruas dari hasil penjumlah
10K4Fe(CN)6 + 35H2SO4 + 300 OH– → 5Fe2(SO4)3 + 20K2SO4 + 60HNO3 + 60CO2 + 310H+ + 610e–
122KMnO4 + 183H2SO4 + 183H+ + 610e– → 122MnSO4 + 61K2SO4 + 61H2O + 427OH–
=============================================================================
10K4Fe(CN)6 + 218H2SO4 + 122KMnO4 → 5Fe2(SO4)3 + 20K2SO4 + 60HNO3 + 60CO2 + 122MnSO4 + 61K2SO4 + 188H2O
SOAL 3 ==Penyetaraan Reaksi Redoks (2 reaksi oksidasi dan 2 reaksi reduksi)==
Problem #5 pada bahasan ChemTeam.info
Metode Setengah Reaksi yang Dimodifikasi Tanpa Pengionan
Soal: CuCNS + KIO3 + HCl → HCN + CuSO4 + ICl + H2O + KClJika diperiksa pada reaksi ini terdapat 2 reaksi oksidasi (atom Cu dan S) dan 2 reaksi reduksi (C dan I), namun di sini tidak akan digunakan metode bilangan oksidasi untuk menyetarakan reaksi tersebut.
Pasangkan molekul–molekul yang memiliki kesamaan atom (tanpa memperhatikan O dan H)
CuCNS → HCN + CuSO4
KIO3 + HCl → ICl + H2O + KCl
Setarakan jumlah atom selain O dan H
CuCNS → HCN + CuSO4
KIO3 + 2HCl → ICl + H2O + KCl
Setarakan jumlah O (tambahkan OH– ruas yang kekurangan O) dan H (tambahkan H+ ruas yang kekurangan H) serta setarakan muatannya dengan menambah e–
|x4| CuCNS + 4OH–→ HCN + CuSO4 + 3H+ + 7e–
|x7| KIO3 + 2HCl + 2H+ + 4e– → ICl + H2O + KCl + 2OH–
Jumlahkan dua reaksi tersebut
4CuCNS + 16OH– → 4HCN + 4CuSO4 + 12H+ + 28e–
7KIO3 + 14HCl + 14H+ + 28e– → 7ICl + 7H2O + 7KCl + 14OH–
=================================================================
4CuCNS + 2OH– + 7KIO3 + 14HCl + 2H+ → 4HCN + 4CuSO4 + 7ICl + 7H2O + 7KCl
Sederhanakan spesi yang muncul pada kedua ruas dari hasil penjumlah
4CuCNS + 2H2O + 7KIO3 + 14HCl → 4HCN + 4CuSO4 + 7ICl + 7H2O + 7KCl
4CuCNS + 7KIO3 + 14HCl → 4HCN + 4CuSO4 + 7ICl + 5H2O + 7KCl
Metode Penyetaraan Bilangan Oksidasi
Soal: CuCNS + KIO3 + HCl → HCN + CuSO4 + ICl + H2O + KClSetarakan atom yang mengalami perubahan bilangan oksidasi saja, kemudian hitung bilangan oksidasinya.
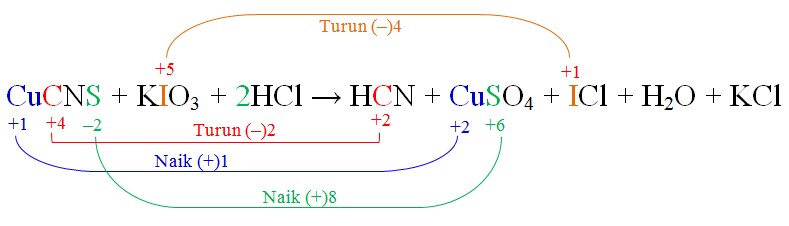 Karena Cu, C, dan S dalam satu molekul CuCNS, maka total perubahan bilangan oksidasi pada CuCNS dapat dijumlahkan menjadi = +1 – 2 + 8 = +7
Karena Cu, C, dan S dalam satu molekul CuCNS, maka total perubahan bilangan oksidasi pada CuCNS dapat dijumlahkan menjadi = +1 – 2 + 8 = +7 Berikutnya adalah menyetarakan bilangan oksidasi antara yang mengalami penaikan (7) dan penurunan (4), sehingga persamaan yang didapat:
(4×1)CuCNS + (7×1)KIO3 + HCl → (4×1)HCN + (4×1)CuSO4 + (7×1)ICl + H2O + KCl
Setarakan atom lain yang tidak mengalami perubahan bilangan oksidasi dengan metode inspeksi (cek dan recek).
4CuCNS + 7KIO3 + 14HCl → 4HCN + 4CuSO4 + 7ICl + 5H2O + 7KCl
Karena reaksi redoks tersebut merupakan bentuk molekuler (tanpa ion), jadi tidak perlu melakukan penyetaraan muatan lagi.
Demikian dan wassalam,
Cara Mudah Menyetarakan Persamaan Reaksi Redoks
Menyetarakan Persamaan Reaksi Redoks
 Diantara
beberapa metode atau cara menyetarakan reaksi redoks ada satu yang saya
rekomendasikan untuk dipilih siswa. Metode penyetaraan persamaan reaksi
redoks tersebut adalah dengan menggunakan metode setengah rekasi yang
dimodifikasi. Bagian yang dimodifikasi adalah pada bagian menyetarakan
jumlah atom O.
Diantara
beberapa metode atau cara menyetarakan reaksi redoks ada satu yang saya
rekomendasikan untuk dipilih siswa. Metode penyetaraan persamaan reaksi
redoks tersebut adalah dengan menggunakan metode setengah rekasi yang
dimodifikasi. Bagian yang dimodifikasi adalah pada bagian menyetarakan
jumlah atom O.Jika metode setengah reaksi adalah dengan menambahkan H2O pada ruas atau sisi yang kekurangan O. Pada metode setengah reaksi yang dimodifikasi ini adalah dengan menambahkan ion OH– untuk sisi yang kekurangan atom O, apapun suasana reaksinya. Urusan suasana akan disesuaikan pada tahap akhir penyetaraan. Pada metode ini tidak memerlukan perhitungan bilangan oksidasi yang untuk sebagian siswa ini kadang merasa menyulitkannya.
Adapun langkah-langkah atau tahapan penyetaraannya adalah sebagai berikut:
- Membagi reaksi menjadi 2 bagian setengah reaksi, kumpulkan spesi-spesi yang memiliki kesamaan atom (kecuali O dan H tidak perlu untuk diperhatikan). Diperbolehkan menambahkan zat yang sama pada dua bagian setengah reaksi jika diperlukan;
- Menyetarakan jumlah atom selain atom O dan H;
- Menyetarakan jumlah atom O dengan menambahkan OH- untuk sisi yang kekurangan O dalam suasana apapun, dan menyetarakan jumlah atom H dengan menambahkan H+ untuk sisi yang kekurangan H;
- Menyetarakan jumlah muatan dengan menambahkan e–;
- Bila perlu mengalikan setiap setengah reaksi dengan bilangan bulat agar elektron yang dilepas sama dengan yang diterima. Ingat reaksi redoks kan reaksi serah terima elektron.
- Menjumlahkan kedua setengah reaksi, dan menuliskan sisa selisih jika dijumpai spesi sama yang ada di ruas kiri dan ruas kanan;
- Menambahkan H+ atau OH– (sesuai dengan suasana yang diminta) pada ruas kiri dan kanan jika diperlukan;
- Jika pada satu ruas terdapat ion H+ dan juga OH– maka perlu mengonversinya jadi molekul H2O;
- Memastikan jumlah atom dan muatan sudah setara.
Na2Cr2O7 + SnI2 + HI → CrI3 + SnI4 + NaI + H2O
- Pisahkan reaksi menjadi 2 setengah reaksi, pastikan senyawa yang berpasangan itu memiliki kesamaan atom (kecuali O dan H)
SnI2 → SnI4 …. (bagian ini pasti akan bermasalah karena jumlah I tidak akan pernah sama kalau kondisinya begitu. Oleh karena itu boleh “diakali” dengan menambahkan HI juga pada ruas kiri. Mengapa dipilih HI , karena ini yang paling mungkin). Sehingga penulisannya menjadi seperti di bawah ini.
SnI2 + HI → SnI4
- Setarakan jumlah atom (selain O dan H) yang ada di ruas kanan dan kiri
SnI2 + 2HI → SnI4
- Setarakan jumlah atom O dan H yang ada di ruas kanan dan kiri
Menyetarakan atom H adalah dengan menambahkan H+ pada ruas yang kekurangan atom H
SnI2 + 2HI → SnI4 + 2H+
- Setarakan muatan ruas kiri dan kanan dengan menambahkan e- pada ruas yang lebih positif
SnI2 + 2HI → SnI4 + 2H+ + 2e–
- Samakan jumlah elektron yang dilepas dengan yang diterima
|x3| SnI2 + 2HI → SnI4 + 2H+ + 2e–
3 SnI2 + 6HI → 3 SnI4 + 6H+ + 6e–
- Jumlahkan spesi (molekul, ion, elektron) yang berada pada ruas yang sama dari kedua reaksi, dan tuliskan sisa hasil selisih untuk spesi yang ada pada kedua ruas
3 SnI2 + 6HI → 3 SnI4 + 6H+ + 6e– +
====================================================================
Na2Cr2O7 + 8HI + 6e– + 3SnI2 + 6HI → 2CrI3 + 2NaI + H2O + 6OH– + 3SnI4 + 6H+ + 6e–
Na2Cr2O7 + 8HI + 3SnI2 + 6HI → 2CrI3 + 2NaI + H2O + 6OH– + 3SnI4 + 6H+
- Pada langkah ini tidak diperlukan penambahan ion H+ atau OH- karena reaksi di atas termasuk reaksi yang telah lengkap, jadi secara otomatis atom H dan OH akan sama (biasanya akan begitu, seperti reaksi ini). Penerapannya coba lihat contoh 2.
- Jika terdapat spesi H+ dan OH- dalam satu ruas dapat di konversi menjadi H2O dan spesi yang sama digabungkan.
Na2Cr2O7 + 14HI + 3SnI2 → 2CrI3 + 2NaI + H2O + 6H2O + 3SnI4
Na2Cr2O7 + 14HI + 3SnI2 → 2CrI3 + 2NaI + 7H2O + 3SnI4
Na2Cr2O7 + 14HI + 3SnI2 → 2CrI3 + 2NaI + 7H2O + 3SnI4
Contoh 2. Setarakan reaksi berikut :
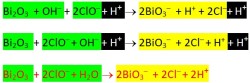
Bi2O3 + ClO–→ BiO3– + Cl–
- Pemecahan menjadi setengah reaksi:
ClO– → Cl–
- Menyamakan jumlah atom selain O dan H:
ClO– → Cl–
- Menyamakan jumlah atom O dengan menambahkan OH- dan menyamakan H dengan menambahkan H+ serta muatan:
Reaksi Reduksi: ClO– + H+ → Cl–+ OH–
- Menyamakan jumlah muatan dengan menambahkan e– dan menyamakan elektron yang dilepas dan yang diterima dengan mengalikan ruas dengan bilangan bulat yang sesuai:
|x2| ClO– + H+ + 2e– → Cl–+ OH–
- Menjumlahkan semua spesi yang ada di setiap ruas dengan membandingkan ruas kiri dan kanan:
2ClO– + 2H+ + 4e– → 2Cl–+ 2OH– +
========================================================
Bi2O3 + 3OH– + 2ClO– + 2H+ + 4e– → 2BiO3– + 3H+ + 2Cl– + 2OH– + 4e–
- Hilangkan setiap ruas jika dijumpai spesi yang sama, biasanya berupa e– dan ion H+ atau ion OH- :
Bi2O3 + OH– + 2ClO– → 2BiO3– + H+ + 2Cl–
- Reaksi dalam suasana asam atau basa?
Bi2O3 + 2ClO– + H2O → 2BiO3– + 2Cl– + 2H+
Bi2O3 + 2ClO– + 2OH– → 2BiO3– + 2Cl– + H2O
Soal dan Pembahasan redoks
Soal & Pembahasan REAKSI REDOKS
Na(s) + Cl2(g)→ NaCl(s)
Mg(s) + N2(g)→ Mg3N2(s)
Kedua reaksi tersebut menurut konsep transfer elektron adalah reaksi redoks, tetapi konsep pelepasan atau pengikatan oksigen/hidrogen tidak dapat menjelaskannya, sebab tidak melibatkan atom hidrogen atau oksigen.
1s22s22p63s23p63d54s2